Hoe is het programma opgebouwd?
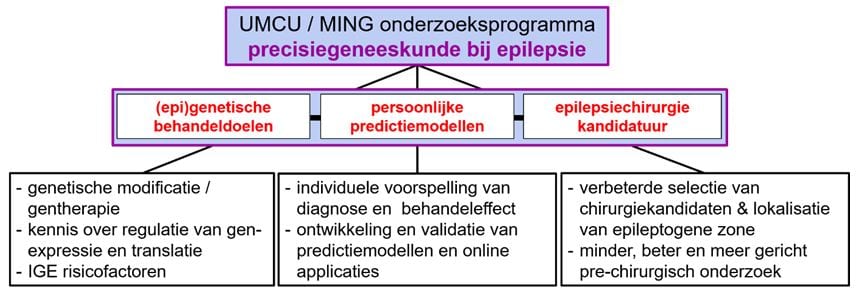
In onderstaand schema worden de drie pilaren van het onderzoeksprogramma weergegeven, met de bijbehorende doelstellingen. De projecten die deels al worden uitgevoerd (met steun van de eerdere donatie) of die de komende jaren gepland gaan worden, vallen direct onder 1 van de 3 pilaren van het onderzoek. Sommige onderzoeksthema’s zullen overlappend zijn: zoals het gebruik van genetische risciofactoren bij de ontwikkeling van nieuwe predictiemodellen of het onderzoek naar genetische biomarkers bij het bepalen van chirurgische kandidatuur en het voorspellen van de kans op postoperatieve aanvalsvrijheid.
Onderzoeksgroep en onderzoeksprogramma
De onderzoeksgroep van het MING-programma bestaat uit de volgende senior onderzoekers (principle investigators, PI’s): prof. dr. K.P.J. Braun, dr. B. Koeleman, dr. F.E. Jansen, dr. E.H. Brilstra, en dr. W.M. Otte. Zij vormen de kern van de groep “Personalized prediction, treatment and genetics in ” van het UMC Utrecht speerpunt Brain, De groep werkt nauw samen met collega-onderzoekers van de UMCU groep “Neurophysiology and surgical tailoring in epilepsy” (prof. dr. G.J.M. Zijlmans, dr. P. van Eijsden, dr. F.E. Leijten, dr. S van der Salm en dr. M van ’t Klooster).
We werken daarnaast samen met onderzoekers van de afdelingen neonatologie, neurochirurgie, pathologie, radiologie en met prof. dr. E. Aronica (Amsterdam UMC), de clinici en onderzoekers van SEIN (Stichting Epilepsie Instellingen Nederland) en met vele centra uit Europese en wereldwijde consortia (zoals EpiCARE, U-TASK, GOSH/UCL London, MOTOL Praag, University Hospitals Lyon, en het ILAE-consortium on common epilepsy, EpiPGX consortium).
Het MING-fonds wordt o.a. aangewend voor:
- de aanstelling van research-verpleegkundigen en een research-coördinator
- de aanstelling van een bio-informaticus, een genetica laboratoriumanalist en een epidemioloog-statisticus
- de aanstelling van meerdere promovendi op specifieke projecten
- kosten voor DNA-onderzoek en andere (epi)genetische analyses
- de financiële inbedding van projecten waarvoor aanvullende externe financiering wordt aangevraagd
- een investering in activiteiten die aanvullende fondsenwerving en donaties kunnen genereren





